Характеристики ковалентного зв’язку
Довжина ковалентного зв’язку
Довжиною ковалентного зв’язку називають відстань між ядрами атомів, що утворюють зв’язок. Довжина зв’язку безпосередньо пов’язана з радіусом атома – чим він більший, тим довший зв’язок.
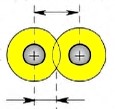
Значення ковалентних радіусів деяких атомів (пм; 10-12 м):
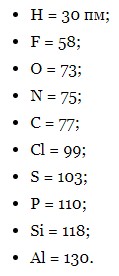
У симетричних молекулах (H2, F2, Cl2…) половину довжини зв’язку називають ковалентним радіусом. Знаючи ковалентний радіус дуже легко обчислювати довжину ковалентного зв’язку в молекулі. Наприклад, довжина ковалентного зв’язку молекули HF = 30 + 58 = 88 пм.
Енергія ковалентного зв’язку
Під енергією ковалентного зв’язку (виражають у ккал/моль або кДж/моль) зазвичай розуміють енергію, яка потрібна для розриву зв’язку (при утворенні ковалентного зв’язку енергія виділяється, при розриві – поглинається). Чим вища енергія зв’язку, тим міцніший зв’язок.
Енергія зв’язку залежить від її довжини – чим довший зв’язок у молекулі, тим простіше її розірвати (витратити менше енергії).
Енергії зв’язку деяких молекул (кДж/моль):
- H2 = 453 (довжина зв’язку = 60 пм);
- Cl2 = 242 (198 пм);
- HCl = 431 (129 пм).
Полярність ковалентного зв’язку
Ця характеристика відображає розташування електронної пари двох атомів, що утворюють зв’язок. Ступінь полярності зв’язку залежить від величини електронегативності атомів, що утворюють зв’язок (що більше, тим більше полярність зв’язку). У більш полярного ковалентного зв’язку загальна пара електронів більше зміщена до більш негативного атома (див. поняття електронегативності).
Електронегативність є табличною величиною, що визначається за шкалою Поллінга. Набагато важливіше знати не саму електронегативність атома як таку, а різницю цих значень у молекулі – який з атомів більш електронегативний, а який менший.
Полярність ковалентного зв’язку оцінюється кількісно за допомогою дипольного моменту (µ), при цьому система двох рівнозначних, але протилежних за знаком, зарядів, називається диполем.
Дуже важливо розрізняти дипольний момент ковалентного зв’язку (її полярність) та дипольний момент молекули загалом. У простих двоатомних молекул ці два параметри рівні між собою. Зовсім інша картина спостерігається у складних молекулах, у яких дипольний момент молекули складається із суми векторів дипольних моментів окремих зв’язків.
Поляризованість ковалентного зв’язку
Поляризованість відображає ступінь здатності електронів зміщуватися під впливом зовнішнього електричного поля, яке формується іонами або іншими полярними молекулами.
Поляризованість ковалентного зв’язку прямо пропорційна її довжині, що, загалом, логічно – що далі від ядра атома знаходиться електрон, тим він слабше їм притягується, тому, легше зміщується при зовнішньому впливі на нього. Таким чином, зі збільшенням довжини зв’язку відбувається збільшення поляризуемості, що, у свою чергу, призводить до зростання сили кислот (наприклад, йодистоводнева кислота сильніша за фтороводородну).
Поляризованість і полярність зв’язку є зворотнозалежними величинами: менш полярний зв’язок більше поляризується, і навпаки.
Насичуваність ковалентного зв’язку
Насиченістю називають здатність атома утворювати певну кількість ковалентних зв’язків – в створенні зв’язку прагнуть взяти участь всі “неспарені” електрони атома. Наприклад, атом водню має лише один неспарений електрон, а атом азоту – три. З цієї причини найбільш стійкою хімічною сполукою буде NH3, але не NH або NH2.
Спрямованість ковалентного зв’язку
Спрямованість характеризує просторову орієнтацію ковалентного зв’язку щодо інших зв’язків молекули. У молекулах електрони ковалентних зв’язків і вільні пари електронів постійно відчувають взаємне відштовхування в результаті чого ковалентні зв’язки розташовуються так, що валентний кут між ними відповідає принципу найменшого відштовхування між електронами (наприклад, в молекулі води валентний кут становить 104,5°).
Кратність ковалентного зв’язку
У деяких випадках між атомами можуть виникати не один, а два (подвійний зв’язок) або три (потрійний зв’язок) загальних електронних пар (так звані кратні зв’язки).
Подвійний ковалентний зв’язок утворюється у атомів, що мають по два неспарені електрони; потрійний – у атомів, що мають по три неспарені електрони (див. Множинні зв’язки).
Як видно з таблиці, наведеної нижче, молекула азоту приблизно в 7 разів “міцніша” за молекулу фтору.
Таблиця залежності довжини та міцності ковалентного зв’язку від її кратності (міцність зв’язку; довжина зв’язку):
- Молекула F2 (одинарний зв’язок) – 139 кДж/моль; 141 пм
- Молекула O2 (подвійний зв’язок) – 494; 121
- Молекула N2 (потрійний зв’язок) – 942; 109

