Формули ковалентних зв’язків
Формули для ковалентних зв’язків докорінно відрізняються від формул для іонних зв’язків. Справа в тому, що ковалентні з’єднання можуть утворюватися різними способами, тому в результаті реакції можлива поява різних сполук.
Емпірична формула
В емпіричній формулі вказуються елементи, з яких складається молекула, з найменшим цілими співвідношеннями.
Наприклад, C2H6O – з’єднання містить два атоми вуглецю, шість атомів водню та один атом кисню.
Молекулярна формула
Молекулярна формула показує, з яких атомів складається з’єднання і в яких кількостях ці атоми в ньому знаходяться.
Наприклад, для сполуки C2H6O молекулярними формулами можуть бути:
![]()
Для повного опису ковалентної сполуки молекулярної формули недостатньо:
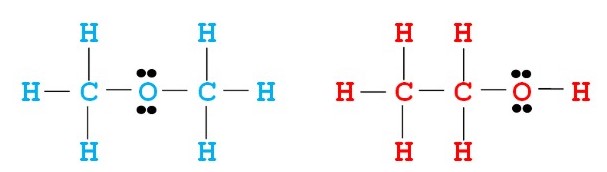
Як бачимо, обидві сполуки мають однакову молекулярну формулу – C2H6O, але є абсолютно різними речовинами:
- диметиловий ефір (блакитний колір) застосовується у холодильних установках;
- етиловий спирт (червоний колір) – основа алкогольних напоїв.
З’єднання, що володіють одним і тим самим якісним і кількісним складом, але різними властивостями, називаються ізомерами.
Структурна формула
Структурна формула служить для точного визначення ковалентного з’єднання, тому, крім елементів з’єднання і кількості атомів, показує ще й схему зв’язків з’єднання.
Як структурну формулу використовують електронно-точкову формулу і формулу Льюїса.

