Електронегативність – що це таке
Електронегативність – це здатність атома в молекулі притягувати до себе електрони
Таке визначення електронегативності дав Л. Полінг у 1932 році. Розберемо електронегативність на простому прикладі, бо ніщо не пояснює так теорію, як практика.
Візьмемо всім добре відому кухонну сіль – хлорид натрію NaCl.
Молекула хлориду натрію утворена іонним зв’язком між атомами хлору та натрію (докладніше див. Що таке іонний зв’язок).
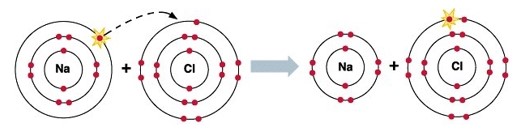
На малюнку добре видно, що в утворенні молекули хлориду натрію беруть участь по одному електрону від кожного атома – натрій віддає свій електрон, а хлор його приймає, в результаті чого у натрію, і хлору завершуються їх зовнішні енергетичні рівні.
Чому натрій віддає свій електрон, а не хлор
А чого саме натрій віддає свій електрон, а не хлор? Чому відбувається саме так, а не навпаки? Це можна пояснити через електронегативність елементів.
Теоретично можуть утворитися дві молекули Na+Cl– і Na–Cl+ (віддаючи електрон, атом набуває позитивного заряду; отримуючи електрон, атом набуває негативного заряду).
Процес переходу електрона від одного атома до іншого неминуче пов’язаний із витратами енергії.
Енергія, що витрачається на відрив електрона від нейтрального атома, називається енергією іонізації (I)
Як тільки електрон залишив атом, він відразу приєднується до іншого атома – цей процес супроводжується виділенням енергії.
Енергія, що виділяється при приєднанні електрона до нейтрального атома, називається спорідненістю до електрона (E)
ВАЖЛИВО! Енергія, що витрачається на відрив електрона від одного атома, і енергія, що виділяється при приєднанні електрона до іншого атома, НЕ РІВНІ! Тобто I ≠ E
Таким чином, кількість енергії, що витрачається на перенесення електрона від одного атома до іншого, буде дорівнює різниці витраченої і виділеної енергії або різниці між енергією іонізації і спорідненістю до електрона:
∑ = I-E
Тепер озвучимо дуже важливе правило, згідно з яким виникають ті іони, на утворення яких потрібно менше енергії.
Кількісна характеристика електронегативності
Повертаємось до нашої молекули хлориду натрію.
- Сума витрат енергії на утворення іонів Na+ та Cl- дорівнюватиме INa-ECl.
- Сума витрат енергії на утворення іонів Na– і Cl+ дорівнюватиме ICl-ENa.
Згідно з озвученим правилом утворення іонів, виникатимуть іони, на утворення яких буде потрібно менше енергії:
![]()
Настав час підставити табличні значення та дізнатися конкретні цифри:
- INa = 5,14 еВ
- ENa = -0,78 еВ
- ICl = 13,01 еВ
- ECl = -3,61 еВ
![]()
Отже, бачимо, що для утворення молекули Na+Cl– потрібно 8,75 еВ, а для утворення молекули Na–Cl+ потрібно 13,79 еВ. Тобто утворити перший варіант молекули набагато «легше», тому утворюватиметься саме молекула Na+Cl–, в якій атом натрію віддає свій електрон, а атом хлору його приймає.
Якщо провести елементарні математичні перетворення, то формулу суми витрат енергії, можна переписати наступним чином:
![]()
або
![]()
Сума енергії іонізації атома (I) та спорідненості до електрона (E) є кількісною характеристикою електронегативності атома χ = I+E
Електронегативність виражають в еВ/атом або кДж/моль.
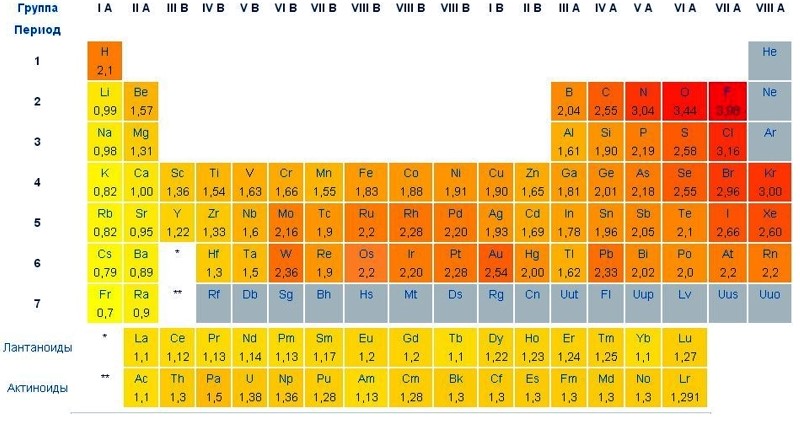
Таблиця електронегативності елементів
Найбільшу електронегативність має атом фтору χF=21,04 еВ, тому, фтор є електронегативним елементом з усієї Періодичної таблиці.
На практиці набагато частіше користуються відносними значеннями електронегативності, які отримані розподілом абсолютних значень електронегативності конкретного елемента на електронегативність літію.
Чому саме електронегативність літію було прийнято за відносну одиницю електронегативності? Важко сказати. Не має значення електронегативність якогось елемента приймати за відносну одиницю.
Слід звернути увагу, що електронегативності атомів у різних джерелах можуть дещо відрізнятися один від одного – це пояснюється тим, що їх значення розраховувалися різними методами, виходячи з конкретних припущень. Незважаючи на невеликі відмінності, відносне розташування елементів у ряді електронегативності постійно.
Навіть побіжного погляду на таблицю електронегативності елементів достатньо, щоб зрозуміти певну закономірність – електронегативність атомів зростає в періоді зі збільшенням його порядкового номера (зліва-направо), а в групах, навпаки, електронегативність зменшується зверху-донизу.
Чим більша відносна електронегативність елемента, тим сильніше він виявляє неметалічні властивості.
Умовна межа електронегативності, що розділяє метали та неметали, дорівнює приблизно 2.
Природа хімічного зв’язку в поєднанні
Знаючи значення відносної електронегативності елемента, можна оцінити природу хімічного зв’язку в поєднанні.
Максимальну електронегативність має атом фтору χF=4,1; мінімальна електронегативність у цезія: χCs = 0,86. Тому, максимальне значення різниці електронегативностей між будь-якими двома елементами Періодичної системи, буде: Aχ=4,1-0,86=3,24.
- Іонний зв’язок – зв’язок атомів з великою різницею електронегативності (3,24..1,9). Такі з’єднання мають високі температури кипіння та плавлення, а також є електропровідниками.
- Ковалентний неполярний зв’язок – зв’язок атомів з невеликою різницею електронегативності, котра приблизно дорівнює нулю. Такі з’єднання мають низькі температури плавлення та кипіння, у воді не дисоціюють на іони.
- Ковалентний полярний зв’язок – зв’язок атомів з різницею електронегативності 1,9..0. Такі сполуки мають проміжні властивості.
За відносною електронегативністю можна приблизно оцінити міцність хімічного зв’язку. Наприклад, у галогеноводородів різниця Aχ між значенням електронегативності водню і галогенами в ряду понижується (відповідно падає і міцність зв’язків):
- HF = 2
- HCl = 0,73
- HBr = 0,64
- HI = 0,11
Тому, з солей плавикової та соляної кислот при їх взаємодії з концентрованою сірчаною кислотою витіснятимуться галогеноводороди, а з солей бромоводневої та йодоводородної кислот, також утворюватимуться бром і йод.
Знаючи відносну електронегативність елементів, що вступають у реакцію, можна визначити в якому напрямку відбуватиметься перехід електронів, тобто, можна визначити який елемент відіграватиме роль окислювача, а який – відновника.
Чим більша відносна електронегативність елемента, тим сильніше його окисні властивості, і, навпаки, чим менше електронегативність – тим сильніше виявляються відновлювальні властивості.
У хімічній номенклатурі, у хімічних формулах бінарних сполук на першому місці записують елемент з меншою електронегативністю, та називають сполуку елемента з більшою електронегативністю, додаючи закінчення “ид”:
- CF4 – фторид вуглецю;
- NCl3 – нітрид хлору;
- ClBr – хлорид брому;
- CS2 – сульфід вуглецю, але не карбід сірки.

