Електролітична дисоціація (шпаргалка)
На цій сторінці зібрана інформація на тему «Електролітична дисоціація», яка допоможе під час вирішення практичних завдань. Така собі «шпаргалка». Теоретичний матеріал наведено на сторінках:
- Що таке електролітична дисоціація
- Механізм електролітичної дисоціації
- Властивості іонів
- Рівняння іонних реакцій
- Алгоритм складання рівняннь іонних реакцій
- Молекулярне рівняння
- Ступінь електролітичної дисоціації
- Константа дисоціації
- Дисоціація кислот
- Дисоціація основ
- Дисоціація солей
- Дисоціація води
- Гідроліз солей
- Гідроліз по аніону, катіону, аніону-катіону
- Ступінчастий гідроліз
- Рівняння іонних реакцій
Ступінь дисоціації
Ступінь дисоціації (α) – відношення кількості молекул, які розпалися на іони (N’), до загальної кількості розчинених молекул (N)
![]()
- α=0 – дисоціація відсутня;
- α=0-3% – слабкі електроліти – слабкі кислоти (H2SO3, H2S, H2SiO3), слабкі основи;
- α=3%-30% – середні електроліти;
- α=30%-100% – сильні електроліти – солі, сильні кислоти (HCl, HBr, HNO3, H2SO4(розч.)) деякі основи (LiOH, KOH, NaOH);
- α=100% – повна дисоціація.
Ступінь дисоціації залежить від концентрації розчину.
Константа дисоціації
Константа дисоціації електроліту (K) – кількісна характеристика дисоціації – відношення добутку концентрації іонів, утворених при дисоціації, до концентрації частинок, що були на початку дисоцціації.
Для електроліту АВ, який дисоціює за рівнянням АВ↔A–+B+:
![]()
Константа дисоціації залежить від концентрації речовин і може коливатися у дуже широкому діапазоні – від 10-16 до 1015.
Ступінь та константа дисоціації пов’язані між собою співвідношенням, званим Законом розведення Оствальда:
![]()
Для слабких електролітів:
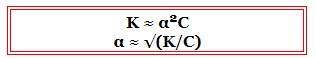
Дисоціація води
Дисоціація води та її константа дисоціації:
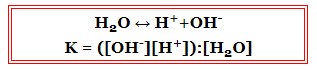
Оскільки вода є дуже слабким електролітом, то концентрація [H2O] є практично незмінною, тому залишається постійною і константа дисоціації води (іонний добуток води):
![]()
Для чистої води:
![]()
В житті дуже часто користуються водневим показником pH=-lg[H+]:
- pH=7 – нейтральне середовище;
- pH<7 – кисле середовище;
- pH>7 – лужне середовище.
Дисоціація кислот та основ
Константа дисоціації одноосновних кислот (Ka – кислотний тип дисоціації; А – кислотний залишок):
![]()
Багатоосновні кислоти дисоціюють у кілька стадій, кожна з яких має свою константу дисоціації.
Константа дисоціації основ позначається Kb.
Дисоціація малорозчинних речовин
Константа дисоціації малорозчинних речовин називається добутком розчинності (ДР).

За наявності у розчині кількох електролітів вони дисоціюють у бік утворення: 1) осадів; 2) газів; 3) слабких електролітів.
Взаємодія солей з водою з утворенням кислої та основної солі називається гідролізом.

