Дисоціація солей
Солі дисоціюють у воді на аніони кислотних залишків та катіони металів (або інших сполук).
Класифікація дисоціації солей
Нормальні (середні) солі утворюються повним одночасним заміщенням всіх атомів водню в кислоті на атоми металу – це сильні електроліти, що повністю дисоціюють у воді з утворенням катіонів металу та однокислотного залишку: NaNO3, Fe2(SO4)3, K3PO4.
Дисоціація нормальної солі:
![]()
Кислі солі містять у своєму складі крім атомів металу та кислотного залишку, ще один (кілька) атомів водню – дисоціюють ступінчасто з утворенням катіонів металу, аніонів кислотного залишку та катіону водню: NaHCO3, KH2PO4, NaH2PO4.
Дисоціація кислої солі:
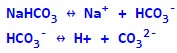
Основні солі містять у своєму складі крім атомів металу та кислотного залишку, ще одну (кілька) гідроксильних груп – дисоціюють з утворенням катіонів металу, аніонів кислотного залишку та гідроксид-іону: (CuOH)2CO3, Mg(OH)Cl.
Дисоціація основної солі:
![]()
Подвійні солі утворюються одночасним заміщенням атомів водню в кислоті на атоми різних металів: KAl(SO4)2.
Дисоціація подвійної солі:
![]()
Змішані солі дисоціюють на катіони металу та аніони кількох кислотних залишків: CaClBr.
Дисоціація змішаної солі:
![]()

