Які чинники впливають на швидкість реакцій
Основні чинники, що впливають на швидкість реакцій
- природа реагуючих речовин;
- концентрація;
- температура;
- каталізатори;
- розміри частинок реагентів;
- тиск.
Останні два пункти відносяться до гетерогенних реакцій.
Природа реагуючих речовин
Необхідною умовою хімічної взаємодії між молекулами речовин є їх зіткнення одна з одною на “потрібній” ділянці молекули, яка називається ділянкою з високою реакційною активністю. Це як у боксі: якщо удар боксера припадає на рукавички суперника, то реакції не буде; а от якщо удар потрапляє у голову суперника, то ймовірність нокауту (реакції) значно зростає; а якщо при цьому сила удару (сила зіткнень молекул) велика, то нокаут (реакція) стає неминучою.
Чим складніше молекула, тим її високореактивна ділянка менше. Тому, чим більше і складніше молекули реагуючих речовин, тим менше швидкість реакції.
Концентрація реагентів
Швидкість реакції прямо пропорційна кількості зіткнень молекул. Чим вище концентрація реагентів, тим більше зіткнень, тим вище швидкість хімічної реакції. Наприклад, горіння в чистому кисні відбувається набагато швидше, ніж на звичайному повітрі.
Проте, слід зазначити, що у складних реакціях, які відбуваються у кілька стадій; така залежність не проглядається. Це дозволяє визначити який з реагентів не задіяний у повільній стадії реакції, яка і визначає саму швидкість реакції.
Залежність швидкості реакції від концентрації речовин, що реагують, виражається законом діючих мас, який був відкритий в 1867 р. норвезькими вченими Гульдбергом і Ваазі.
Швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин
Швидкість (v) умовної реакції, що описується рівнянням
![]()
, відповідно до закону діючих мас, обчислюватиметься за формулою, яка зветься формулою кінетичного рівняння реакції:
![]()
- [A], [B] – концентрації вихідних речовин;
- k – константа швидкості реакції, що дорівнює швидкості даної реакції при концентраціях реагуючих речовин, що дорівнює 1 моль кожна.
k не залежить від концентрації реагуючих речовин, але залежить від їхньої природи та температури.
За кінетичним рівнянням реакції можна визначити швидкість зміни реакції залежно від зміни концентрації речовин, що реагують.
Приклади кінетичних рівнянь:

Зверніть увагу, що до кінетичних рівнянь не входять концентрації твердих речовин, а тільки газоподібних і розчинених.
Температура реагентів
При підвищенні температури молекули рухаються швидше, тому зростає кількість їх зіткнень. Крім цього, збільшується кінетична енергія молекул, що підвищує ефективність зіткнень, які в кінцевому рахунку визначають швидкість реакції.
Згідно з теорією активації, у хімічній реакції можуть взяти участь лише молекули, що мають енергію, яка перевищує якусь середню величину. Розмір перевищення середньої енергії молекул зветься енергією активації. Ця енергія необхідна для послаблення хімічних зв’язків у молекулах вхідних речовин. Молекули, що мають необхідну надмірну енергію, що дозволяє їм вступати в реакцію, називаються активними молекулами. Чим вище температура, тим більше активних молекул, тим вища швидкість реакції.
Залежність швидкості реакції від температури характеризується правилом Вант-Гоффа:
При підвищенні температури на 10°C швидкість більшості реакцій зростає в 2-4 рази
Математично правило Вант-Гоффа виражається такою формулою:
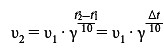
- γ – температурний коефіцієнт, що показує збільшення швидкості реакції при підвищенні температури на 10°C;
- v1 – швидкість реакції при температурі t1;
- v2 – швидкість реакції при температурі t2;
Каталізатори
Каталізатори – це речовини, які впливають на швидкість реакції, але при цьому самі не витрачаються.
Зміна швидкості хімічної реакції під впливом каталізатора називається каталізом
Каталітичні реакції – це реакції, що відбуваються за участю каталізаторів
Основна дія каталізатора – зниження енергії активації реакції, внаслідок чого зростає кількість ефективних зіткнень молекул.
Каталізатори можуть прискорювати реакцію у мільйони разів!
Розрізняють два види каталізу:
- гомогенний (однорідний) каталіз – каталізатор та реагенти утворюють одну фазу: газ або розчин;
- гетерогенний (неоднорідний) каталіз – каталізатор перебуває у вигляді самостійної фази.
Механізм каталітичних реакцій дуже складний і остаточно невідомий. Згідно з однією з наукових гіпотез, в каталітичних реакціях каталізатор і реагент вступають у реакцію з утворенням проміжної сполуки, яка значно активніше реагує з іншою вхідною речовиною з утворенням кінцевого продукту реакції, при цьому сам каталізатор виділяється у вільному стані.
Зазвичай під каталізаторами розуміють речовини, що прискорюють реакцію, але є речовини, що уповільнюють перебіг реакції – вони називаються інгібіторами.
Біологічні каталізатори називаються ферментами. Ферменти є білками.
Розмір частинок реагентів
Візьмемо сірник і піднесемо до шматка вугілля. Навряд чи вугілля встигне спалахнути, поки сірник не погасне. Подрібнимо вугілля та повторимо експеримент – вугільний пил не просто загориться, а дуже швидко загориться – станеться вибух (основна небезпека у вугільних шахтах). Що ж відбувається?
Подрібнивши вугілля, тим самим ми різко збільшуємо площу його поверхні. Чим більша площа поверхні, на якій відбуваються зіткнення молекул, тим вища швидкість реакції.
Тиск реагентів
Тиск газоподібних реагентів діє аналогічно їх концентрації – чим вищий тиск – то вища концентрація – то вища швидкість реакції, тому кількість зіткнень молекул зростає. Як і концентрація, тиск реагентів не “працює” у складних реакціях.

