Швидкість хімічних реакцій
Знання швидкостей хімічних реакцій має велике теоретичне та практичне значення. Наприклад, у хімічній промисловості при виробництві речовини від швидкості реакції залежать розміри і продуктивність апаратури, кількість продукту, що отримується.
У різних хімічних реакцій – різна швидкість. Деякі реакції протікають протягом часток секунди, для реалізації інших потрібні місяці, або навіть роки. Швидкість перебігу хімічних реакцій вивчає хімічна кінетика.
Основні поняття, з якими оперує хімічна кінетика – це хімічна система та фаза:
- Хімічна система – речовина (сукупність речовин);
- Хімічна фаза – частина системи, відокремлена з інших частин поверхнею розділу.
Системи, що складаються з однієї фази, називаються однорідними або гомогенними, наприклад газові суміші або розчини. Реакції, які відбуваються у гомогенних системах, називаються гомогенними реакціями, такі реакції протікають у всьому обсязі суміші.
Системи, що складаються з декількох фаз, називають неоднорідними або гетерогенними, наприклад, рідина + тверда речовина. Реакції, які відбуваються у гетерогенних системах, називаються гетерогенними реакціями, такі реакції протікають тільки на поверхні розділу фаз.
Швидкість гомогенної реакції
![]()
Швидкістю гомогенної реакції називають кількість речовини (ν), що утворюється в результаті реакції за одиницю часу (t) в одиниці об’єму системи (V):
- ν1 – кількість молей речовини в момент часу t1;
- ν2 – кількість молей речовини в момент часу t2;
Мольно-об’ємна концентрація речовини (С, моль/л) – відношення кількості молей речовини (ν) до всього обсягу реакційної суміші (V): С=ν/V.
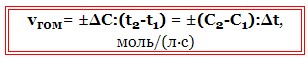
Швидкість гомогенної реакції дорівнює зміні концентрації речовини, що реагує, в одиницю часу.
У тому випадку, якщо йдеться про концентрацію одного з продуктів реакції, у виразі ставиться знак “плюс”, якщо про концентрацію однієї з начальних речовин – знак “мінус”.
Швидкість гетерогенної реакції
![]()
Як було зазначено вище, головна відмінність гетерогенних реакцій від гомогенних у тому, що реакція відбувається на межі розділу фаз.
Швидкістю гетерогенної реакції (vгет) називається кількість речовини (ν), що утворюється за одиницю часу (t) на одиниці поверхні розділу фаз (S).

