Водневий зв’язок
Хімічні зв’язки утворюються як між атомами, але, і між молекулами. Одним з таких видів зв’язку є водневий зв’язок, що виникає між молекулами, до складу яких входить водень і елемент з високою електронегативністю, пов’язаний з атомом водню ковалентним полярним зв’язком (загальна електронна пара зміщена до більш негативного атома, а атом водню стає частково позитивно зарядженим): HF; H2O; NH3; HCl; H2S та ін.
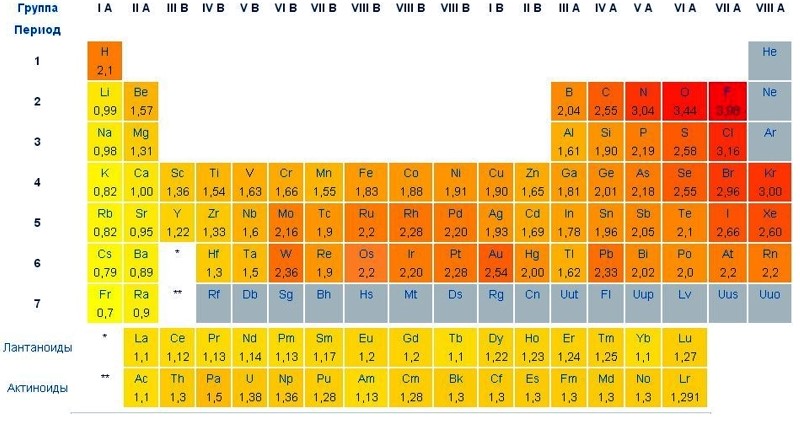
Поняття електронегативності (здатності атомів у хімічних зв’язках притягувати до себе електрони) вперше у практику ввів у 1932 році американський хімік Л. Полінг. Хіміки частіше користуються відносними значеннями електронегативності, причому абсолютні величини електронегативності, визначені різними методами, дещо відмінні один від одного. Загалом за періодичною таблицею простежується чітка залежність – електронегативність хімічних елементів у періодах збільшується зліва направо, а в групах зменшується зверху вниз.
Найбільшу електронегативність мають неметали:
![]()
У водневому зв’язку роль донора відіграє електронегативний елемент, що має частковий негативний заряд і вільні електронні пари; роль акцептора відведена атому водню.
Водневий зв’язок не утворюється в сполуках водню з елементами, електронегативність яких близька до електронегативності водню: СН4; PH3…
Механізм утворення водневого зв’язку
Простежимо механізм утворення водневого зв’язку у молекулі води. Оскільки ковалентний зв’язок О – Н сильно полярний, то на атомі водню утворюється частковий позитивний заряд, а на атомі кисню – частково негативний, що призводить до сильного зміщення електрона водню, при цьому його орбіталь виявляється практично вільною і починає взаємодіяти вільна електронна пара атома кисню іншої молекули води – це і є водневий зв’язок, при якому один з атомів водню розташований між двома електронегативними атомами кисню, з одним з яких зв’язується ковалентним зв’язком.
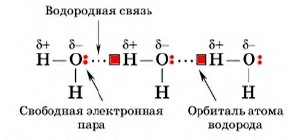
Завдяки водневим зв’язкам молекули можуть поєднуватися в асоціати.
Слід сказати, що сила водневого зв’язку приблизно на порядок менша за ковалентну (для її розриву достатньо 10-100 кДж/моль енергії). Однак, незважаючи на це, водневі зв’язки істотно впливають на такі фізико-хімічні властивості сполук, як температура кипіння, плавлення, розчинність у воді. Наприклад, речовини з водневим зв’язком (вода, низькомолекулярні спирти, аміак та ін.) мають досить високі температури кипіння, оскільки для розриву множинних водневих зв’язків потрібна додаткова енергія.
Речовини, здатні утворювати водневі зв’язки з молекулами розчинника, мають хорошу розчинність. Також водневі зв’язки досить поширені в природі, часто зустрічаються в білкових сполуках і нуклеїнових кислотах. У процесі обміну речовин в організмі також утворюються та розщеплюються водневі зв’язки.

