Що таке моль
Моль – одне з найважливіших понять у хімії, – це, свого роду, ланка для переходу з мікросвіту атомів і молекул у звичайний макросвіт грамів та кілограмів.
У хімії часто доводиться рахувати велику кількість атомів і молекул. Для швидкого та ефективного підрахунку прийнято користуватися методом зважування. Але при цьому треба знати вагу окремих атомів і молекул. Для того, щоб дізнатися молекулярну масу, треба скласти масу всіх атомів, що входять у з’єднання.
Візьмемо молекулу води H2O, що складається з одного атома кисню та двох атомів водню. З періодичної таблиці Менделєєва дізнаємося, що один атом водню важить 1,0079 а.о.м, а один атом кисню – 15,999 а.о.м. Тепер, щоб обчислити молекулярну масу води, треба скласти атомні маси компонентів молекули води:
![]()
Наприклад, для сульфату амонію молекулярна маса дорівнюватиме:
![]()
Повернемося знову до повсякденного життя, в якому ми звикли користуватися такими поняттями, як пара, десяток, дюжина, сотня. Все це своєрідні одиниці виміру певних об’єктів: пара черевиків, десяток яєць, сотня скріпок. Подібною одиницею вимірювання хімії є МОЛЬ.
Число Авогадро
Сучасна наука з високою точністю визначила кількість структурних одиниць (молекули, атоми, іони…), що містяться в 1 молі речовини – це 6,022·1023 – постійна Авогадро, або число Авогадро.
NA = 6,022 · 1023 моль-1
Постійна Авогадро показує кількість структурних одиниць в одному молі речовини
Усе сказане про молі відноситься до мікросвіту. Тепер треба ув’язати поняття моля з повсякденним макросвітом.
Весь нюанс полягає в тому, що в 12 грамах ізотопу вуглецю 12C міститься 6,022·1023 атомів вуглецю, або рівно 1 моль. Таким чином, для будь-якого іншого елемента моль виражається кількістю грамів, що дорівнює атомній масі елемента. Для хімічних сполук моль виражається кількістю грамів, що дорівнює молекулярній масі сполуки.
Трохи раніше ми з’ясували, що молекулярна маса води дорівнює 18,015 а.о.м. З урахуванням отриманих знань про молі, можна сказати, що маса 1 моля води = 18,015 грамів (моль сполуки – це кількість грамів, рівних його молекулярної масі). Інакше кажучи, можна сказати, що у 18,015 грамах води міститься 6,022·1023 молекул H2O, або 1 моль води = 1 моль кисню + 2 моля водню.
З наведеного прикладу зрозумілий зв’язок мікросвіту і макросвіту через моль:
Число Авогадро ↔ МОЛЬ ↔ кількість грамів, рівних атомній (формульній) масі
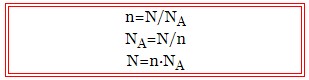
- n – кількість речовини, моль;
- N – кількість частинок;
- NA – число Авогадро, моль-1
Приклади вирішення задач на молі
Наведемо кілька практичних прикладів використання моля:
Завдання №1: Скільки молекул води міститься у 16,5 молях H2O?
Рішення: 16,5 · 6,022 · 1023 = 9,93 · 1024 молекул.
Завдання №2: Скільки молей міститься у 100 грамах H2O?
Рішення: (100 г/1) · (1 моль/18,015 г) = 5,56 моль.
Завдання №3: Скільки молекул містить 5 г діоксиду вуглецю?
Рішення:
- Визначаємо молекулярну масу CO2 = 1 · 12,011 + 2 · 15,999 = 44,01 г/моль
- Знаходимо число молекул: (5г/1)·(1моль/44,01г)·(6,022·1023/1моль) = 6,84·1022 молекул CO2

