Ковалентний зв’язок
Ковалентний зв’язок – хімічний зв’язок, який утворюється за рахунок спільного використання двома атомами хоча б однієї пари електронів
В основу ковалентного зв’язку покладено принцип спільного використання електронів як прагнення заповнення валентних рівнів енергії.
Схему ковалентного зв’язку розглянемо на прикладі молекули водню. Зазвичай у природі водень зустрічається не у вигляді окремого атома, а у вигляді двоатомної молекули – Н2.
Водень має один валентний електрон і йому потрібен ще один, щоб заповнити перший енергетичний рівень (електронна формула атома водню = 1s1). Атом водню може “запозичити” недостатній електрон в іншого атома водню. Але, у такому разі, атом водню, який віддав свій єдиний електрон, стане ще більш нестабільним. Тому такий варіант неможливий.
Єдино можливим варіантом з’єднання H2 може бути лише спільне використання електронів. Два електрони начебто “належать” обом атомам водню. Утворення хімічного зв’язку між атомами водню є результатом перекриття електронних орбіталей, що відбувається при зближенні атомів. Такий вид зв’язку називається ковалентним зв’язком.
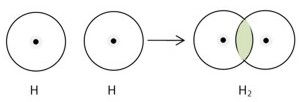
- Електронно-крапкова формула:
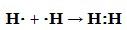
- Структурна формула Льюїса:

У кожного атома водню в молекулі формується конфігурація атома гелію.
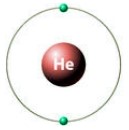
Утворення міцного хімічного зв’язку в молекулі водню здійснюється за рахунок перекриття s-орбіталей атомів, завдяки чому між ядрами атомів водню створюється підвищена електронна щільність, через що електрони молекули водню зазнають тяжіння одночасно двох ядер.
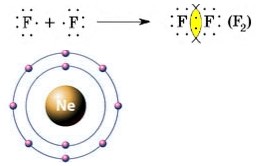
Згідно з теорією Електронної структури атомів, атоми хімічних елементів у молекулах прагнуть отримати стабільну електронну конфігурацію найближчого інертного газу. Наприклад, при злитті атомів фтору в молекулу утворюється конфігурація неону:
Крім водню у природі існує ще 6 елементів (простих речовин), що мають двоатомну молекулу:
![]()
- Іонний зв’язок (ІЗ) утворюється між металом та неметалом.
- Ковалентний зв’язок (КЗ) утворюється між двома неметалами.
У цих зв’язків різні властивості:
- при кімнатній температурі з’єднання з ІЗ зазвичай тверді речовини; сполуки з КЗ можуть перебувати у твердому, рідкому та газоподібному стані;
- точка плавлення для іонних сполук зазвичай набагато вища, ніж для ковалентних;
- ІЗ – електроліти (проводять електричний струм); КЗ – неелектроліти.
Слід сказати, що ковалентні зв’язки можуть також виникати між різними атомами. Наприклад, у молекулі фтороводню (HF) єдиний атом водню, розташований на s-орбіталі, перекривається з непарним атомом фтору, який знаходиться на p-орбіталі, таким чином, у молекулі HF атом водню отримує електронну конфігурацію гелію, а атом фтору – конфігурацію неона.
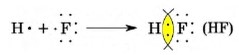
Оскільки у взаємодіючих атомів водню і фтору різний електронегативний заряд, загальна електронна пара, що утворилася, зміщується до більш електронегативного атома фтору, з утворенням ковалентного полярного зв’язку (у молекулах простих речовин ковалентний зв’язок неполярний).
Вище було розглянуто утворення ковалентного зв’язку за рахунок загальної пари двох атомів. Існує ще один механізм утворення ковалентного зв’язку, який називається координаційним чи донорно-акцепторним.
При донорно-акцепторному механізмі утворення ковалентного зв’язку хімічний зв’язок утворюється за рахунок електронної пари (неподіленої пари електронів), яку постачає один з атомів (донор), причому інший атом (акцептор) надає для цієї електронної пари свою вільну орбіталь.

