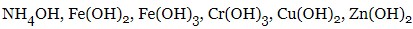Що таке гідроліз солі
Гідроліз солі – це взаємодія іонів солі з іонами води, що призводить до утворення слабкого електроліту
У загальному випадку під гідролізом розуміють обмінне розкладання речовин водою, як органічних, так і неорганічних. З неорганічних речовин найчастіше гідролізу піддаються солі.
Кількісно гідроліз солі характеризується ступенем гідролізу, який залежить від природи самої солі, концентрації розчину, температури:
Ступінь гідролізу (h) дорівнює відношенню числа гідролізованих молекул (n) до загального числа розчинених молекул (N)
h=n/N
Схема реакції гідролізу:
![]()
- XY – сіль;
- HOH – молекула води;
- XH – кислота;
- HOY – основа.
Швидкість гідролізу зростає з:
- підвищенням температури;
- збільшенням розведення розчину.
Реакція гідролізу, як правило, оборотна, при цьому рівновагу реакції можна зміщувати в ту чи іншу сторону, додаючи до розчину солі сильну кислоту або сильну основу.
Усього можливі 4 варіанти гідролізу солей, залежно від способу утворення солі:
- гідроліз по катіону – сіль утворена сильною кислотою та слабкою основою:
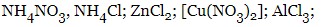
- гідроліз по аніону – сіль утворена слабкою кислотою та сильною основою:
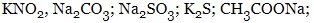
- гідроліз по катіону та аніону – сіль утворена слабкою кислотою та слабкою основою:
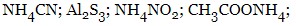
- солі, утворені сильною кислотою та сильною основою, гідролізу не піддаються.
| – | Сильні основи | Слабкі основи |
| Сильні кислоти | гідролізу немає pH=7 | гідроліз по катіону pH<7 |
| Слабкі кислоти | гідроліз по аніону pH>7 | гідроліз по катіону та аніону pH≈7 |
- сильні кислоти:
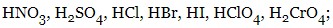
- слабкі кислоти:
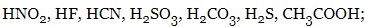
- сильні основи:
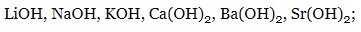
- слабкі основи: