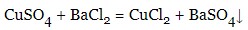Хімічні властивості солей, отримання солей
- Солі реагують з металами (більш активний метал витісняє із солі менш активний), які в ряді стандартних електронних потенціалів стоять попереду металу, що входить до складу солі:
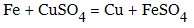
- реагують з водорозчинними основами (більш сильні основи витісняють із солі слабші), при цьому в реакцію вступають тільки солі, що дають нерозчинні гідроксиди при дії лугів:
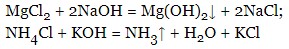
- реагують з кислотами (реакція йде до кінця, якщо один із продуктів виділяється у вигляді газу або випадає в осад):
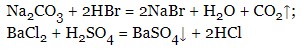
- солі можуть вступати в реакцію одна з одною (обмінні реакції), утворюючи при цьому важкорозчинні солі:
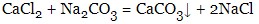
- гідрокарбонати, карбонати та нітрати при нагріванні розкладаються:
- гідрокарбонати перетворюються на карбонати при легкому нагріванні:
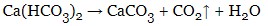
- при більш високих температурах карбонати розкладаються до оксиду та вуглекислого газу (температура розкладання зростає з активністю металу):
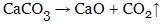
- карбонати лужних металів при нагріванні не розкладаються;
- продукти розкладання нітратів під час нагрівання залежать від активності металу, що входить до складу солі (див. таблицю електрохімічного ряду напруг металів, розташовану нижче):
- для металів, що стоять ліворуч від магнію: 2NaNO3 = 2NaNO2 + O2↑
- для металів, що стоять між магнієм і міддю: 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
- для металів, що стоять правіше за мідь: 2AgNO3 = 2Ag + 2NO2↑ + O2↑
- гідрокарбонати перетворюються на карбонати при легкому нагріванні:

Отримання солей
Солі отримують в результаті взаємодії кислот з такими речовинами:
- метали (до H):
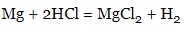
- основні оксиди:
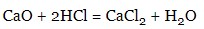
- основи:
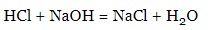
- солі:
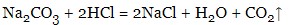
Солі отримують в результаті взаємодії основ з такими речовинами:
- неметали:
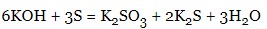
- кислотні оксиди:
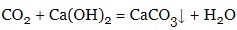
- солі:
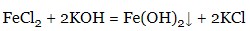
Солі отримують, як наслідок взаємодії наступних речовин:
- металів з неметалами:
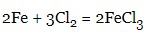
- кислотних та основних оксидів:
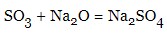
- солі з металом:
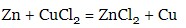
- двох солей: