Принцип Ле Шательє
Принцип Ле Шательє говорить:
Якщо на систему, що знаходиться в рівновазі, вплинути, то в результаті процесів, що починають відбуватися, рівновага зміститься в такому напрямку, щоб вказаний вплив зменшився
Як це розуміти? Все дуже просто. Порушити рівновагу можна трьома способами:
- змінивши концентрацію речовини;
- змінивши температуру;
- змінивши тиск.
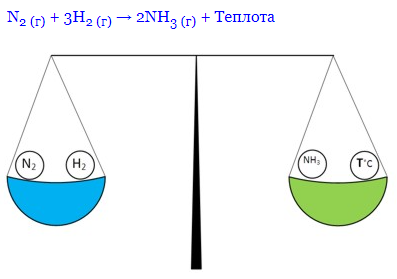
Коли реакція синтезу аміаку перебуває у рівновазі, це можна зобразити так (реакція екзотермічна):
Змінюємо концентрацію
Введемо додаткову кількість азоту у збалансовану систему. При цьому баланс порушиться:
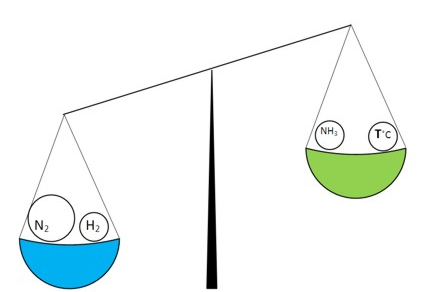
Пряма реакція почне протікати швидше, оскільки кількість азоту збільшилася і він входить у реакцію у більшій кількості. Через деякий час знову настане хімічна рівновага, але при цьому концентрація азоту буде більшою, ніж концентрація водню:
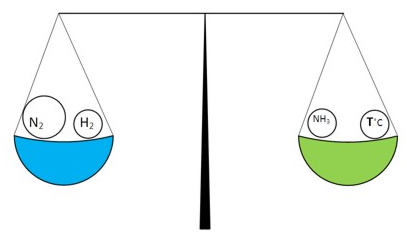
Але, здійснити “перекіс” системи в ліву частину можна й іншим способом – “полегшивши” праву частину, наприклад, відводити аміак із системи в міру його утворення. Т.ч., знову переважатиме пряма реакція утворення аміаку.
Змінюємо температуру
Праву сторону наших “ваг” можна змінювати шляхом зміни температури. Для того щоб ліва частина “переважила”, необхідно “полегшити” праву частину – зменшити температуру:

Змінюємо тиск
Порушити рівновагу в системі за допомогою тиску можна лише у реакціях із газами. Збільшити тиск можна двома способами:
- зменшенням обсягу системи;
- запровадженням інертного газу.
У разі збільшення тиску кількість зіткнень молекул зростає. При цьому підвищується концентрація газів у системі та змінюються швидкості прямої та зворотної реакцій – рівновага порушується. Щоб відновити рівновагу система “намагається” зменшити тиск.
Під час синтезу аміаку з 4-х молекул азоту та водню утворюється дві молекули аміаку. Таким чином кількість молекул газів зменшується – тиск падає. Як наслідок, щоб дійти рівноваги після збільшення тиску, швидкість прямої реакції зростає.
Підведемо підсумок. Відповідно до принципу Ле Шательє збільшити виробництво аміаку можна:
- збільшуючи концентрацію реагентів;
- зменшуючи концентрацію продуктів реакції;
- зменшуючи температуру реакції;
- збільшуючи тиск, при якому відбувається реакція.

