Класифікація хімічних реакцій
Усі хімічні реакції можна класифікувати за різними ознаками:
- щодо зміни кількості вихідних речовин і продуктів реакції
- з виділення/поглинання енергії
- за наявністю каталізатора
- за ознакою оборотності реакції
- за типом частинок
- за типом енергетичної дії
- за агрегатним станом середовища
Класифікація реакцій щодо зміни кількості вихідних речовин і продуктів реакції
- реакції приєднання – з кількох речовин утворюється нова речовина:
С + О2 = СО2; - реакції розкладання – з однієї речовини утворюється кілька інших:
CaCO3 = CaO + CO2; - реакції заміщення – в результаті реагування простої та складної речовини утворюються нові складні та прості речовини:
2Na +2H2O = 2NaOH + H2; - реакції обміну – реагенти обмінюються складовими частинами:
MgS + 2HCl = MgCl2 + H2S; - реакції нейтралізації (є окремим випадком реакцій обміну) – вихідними речовинами реакції виступають кислота і основа, а продуктами – вода і сіль:
NaOH + HCl = NaCl + H2O
Класифікація реакцій щодо виділення/поглинання енергії
- екзотермічні реакції (з виділенням тепла):
C + O2 = CO2 + Q - ендотермічні реакції (з поглинанням тепла):
N2 + O2 = 2NO – Q
Класифікація реакцій щодо наявності каталізатора
Каталізаторами називають речовини, які не беруть безпосередньої участі у самій реакції, але змінюють швидкість її протікання.
- каталітичні реакції:
CO + H2O = CO2 + H (каталізатор FeO) - некаталітичні реакції
Класифікація реакцій за ознакою оборотності реакції
оборотні реакції – можуть мимовільно протікати за таких умов, як у прямому, так і у зворотному напрямку:
N2(г) + 3H2(г) ↔ 2NH3(г)
незворотні реакції – протікають тільки в одному напрямку з практично повним перетворенням вихідних речовин на продукти реакції (один із продуктів є газоподібною або слабодисоціюючою речовиною):
CaCO3 = CaO + CO2
Класифікація реакцій на кшталт частинок
- молекулярні;
- іонні;
- радикальні.
Класифікація реакцій на кшталт енергетичного впливу
- термохімічні реакції – протікають за підвищеної температури:
N2 + O2 = 2NO; - фотохімічні реакції – протікають під впливом світла:
H2 + Cl2 = 2HCl; - електрохімічні реакції – протікають під впливом електричного струму:
2NaCl = 2Na + Cl2.
Класифікація реакцій щодо агрегатного стану середовища
- гомогенні реакції – протікають в однорідному середовищі, наприклад, в газоподібному або рідкому середовищі:
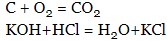
- гетерогенні реакції – протікають на межі розділу двох речовин, що знаходяться в різних фазах (твердо-газоподібної; рідко-газоподібної, твердої-рідкої; рідкої-рідкої; твердої-твердої):
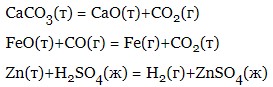
Гомогенні та гетерогенні реакції, у свою чергу, поділяються на прості (у системі протікає лише одна реакція, як правило, необоротна) та складні (у системі протікає одночасно кілька простих реакцій).

