Тепловий ефект хімічної реакції
Будь-яка хімічна реакція протікає або з виділенням або з поглинанням тепла.
Екзотермічні реакції – реакції, у процесі яких виділяється енергія:
- C+O2 = CO2 – горіння вугілля;
- H2SO4+2KOH = K2SO4+2H2O – реакція кислоти з лугом
Ендотермічні реакції – реакції, в процесі яких поглинається енергія (наведені нижче реакції протікають лише при нагріванні):
- CaCO3 = CaO+CO2 – розкладання карбонату кальцію;
- N2+O2 = 2NO – утворення оксиду азоту.
Тепловий ефект реакції (Q) – це кількість теплоти, що виділяється або поглинається в ході хімічної реакції
Тепловий ефект реакції виражається в кілоджоулях (кДж) та позначається буквою Q.
- Q>0 – для екзотермічних реакцій;
- Q<0 – для ендотермічних реакцій.
Суть теплового ефекту хімічної реакції безпосередньо пов’язана із законом збереження енергії, згідно з яким, енергія не виникає з нічого і нікуди не дівається безслідно, а лише переходить з одного стану в інший.
Внутрішня енергія речовини
Якщо в процесі хімічної реакції відбувається виділення енергії, значить, ця енергія була укладена раніше в речовині, що вступила в реакцію, в ході якої відбулося вивільнення цієї енергії, яку називають внутрішньою енергією речовини (позначається U).
І навпаки, якщо в ході реакції енергія була поглинена ззовні, значить вона акумулювалася в продукті ендотермічної реакції у вигляді внутрішньої енергії речовини, що знову утворилася.
Таким чином, якщо при утворенні речовини було витрачено певну кількість енергії, то при її розкладанні це ж кількість енергії буде виділено. Звідси можна зробити дуже важливий висновок – чим більше енергії виділяється при утворенні речовини, стільки ж її треба витратити і на її розкладання. Тому ті речовини, при утворенні яких було виділено багато енергії, важко піддаються розкладанню і є дуже стійкими (наприклад, багато полімерів).
Як відомо з курсу фізики, енергія тіла складається з потенційної та кінетичної енергії. У хімії кінетична енергія речовини обумовлена енергією руху його частинок (чим швидше рухаються частинки, тим вища кінетична енергія речовини); потенційна енергія визначається силами тяжіння та відштовхування між частинками.
Тип хімічної реакції
Оскільки будь-яка речовина складається з деякої кількості частинок, які знаходяться в постійному русі, отже, вона має деякий запас внутрішньої енергії. У ході хімічних реакцій відбувається перетворення речовин із зміною їхньої внутрішньої енергії на той чи інший бік, що супроводжується виділенням чи поглинанням теплоти.
У ході хімічної реакції в молекулах вихідних речовин відбувається розрив внутрішніх зв’язків, що вимагає певної кількості енергії (поглинання тепла), одночасно з цими процесами, в молекулах продуктів реакції відбувається утворення нових зв’язків, що супроводжується виділенням тепла. Співвідношення поглиненого та виділеного тепла в процесі хімічної реакції та визначає тип усієї реакції в цілому, є вона екзотермічною або ендотермічною.
Схематично це можна виразити так:
![]()
- A-A – хімічний зв’язок у молекулі А2;
- В-В – хімічний зв’язок у молекулі В2;
- А-В – хімічна зв’язок в утвореній молекулі АВ;
- EA – енергія, що поглинається при розриві зв’язку в молекулі А2;
- EВ – енергія, що поглинається при розриві зв’язку в молекулі В2;
- EAB – енергія, що виділилася при утворенні нового зв’язку в молекулі АВ;
- Якщо (EA+EB) < 2EAB – екзотермічна реакція;
- Якщо (EA+EB) > 2EAB – ендотермічна реакція;
Позначимо через U1 кількість внутрішньої енергії початкового стану системи (суму внутрішніх енергій вихідних компонентів реакції), через U2 позначимо кількість внутрішньої енергії кінцевого стану системи (суму внутрішніх енергій продуктів реакції). Різницю внутрішніх енергій кінцевого та початкового стану системи позначимо ΔU.
За законом збереження енергії, якщо до системи підводиться деяка кількість теплоти Q, вона буде витрачатися на зміну внутрішньої енергії системи (ΔU) і на виконання роботи (А):
![]()
Говорячи про роботу (A) стосовно хімічних реакцій, мають на увазі роботу проти зовнішнього тиску земної атмосфери (p). Більшість хімічних реакцій протікають в умовах постійного тиску (p=const), тому роботу можна записати, як добуток тиску на зміну обсягу вихідних речовин (V1) та продуктів реакції (V2):
![]()
Виходячи з прийнятих позначень тепловий ефект хімічної реакції, яка протікає при постійному тиску, можна виразити наступним чином:
![]()
Розкриваємо дужки та проводимо угруповання:

Суму в дужках позначимо через букву H, тоді рівність набуде наступного вигляду:
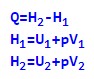
Сума внутрішньої енергії речовини та тиску на його обсяг називається ентальпією (H).

