Закон Геса
Закон Геса є окремим випадком закону збереження енергії:
Тепловий ефект реакції не залежить від проміжних стадій процесу, а лише від початкового та кінцевого стану речовин
Іншими словами, відповідно до закону Геса, тепловий ефект реакції не залежить від шляху перетворення початкових речовин на продукти реакції.
З закону Геса випливає два важливі наслідки:
- Теплота утворення речовини (ΔH°утв) дорівнює тепловому ефекту хімічної реакції утворення 1 моля речовини із стійких найпростіших речовин (при н.у.).
- Теплота згоряння речовини (ΔH°згор), що містить C, H, N, O, дорівнює тепловому ефекту реакції згоряння 1 моля цієї речовини при достатній кількості кисню з утворенням CO2, H2O, N2.
Виходячи з першого наслідку закону Геса, тепловий ефект будь-якої реакції може бути розрахований по теплотах утворення речовин, що беруть участь у цій реакції.
Тепловий ефект реакції дорівнює різниці суми теплот утворення продуктів реакції та суми теплот утворення початкових продуктів
Для умовної реакції виду aA+bB=cC+dD тепловий ефект дорівнюватиме:
ΔH°=(cΔH°утв.С+dΔH° утв.D)-(aΔH° утв.A+bΔH° утв.B)
Таблиця теплот утворення складних речовин за н.у (ΔHутв., кДж)
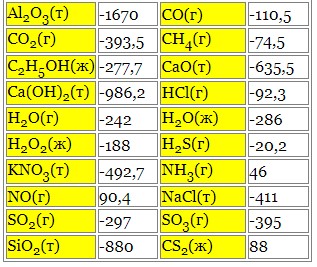
Теплоти утворення стійких простих речовин дорівнюють нулю (при н.у.).
Виходячи з другого наслідку закону Гесса, теплові ефекти деяких реакцій можуть бути розраховані за теплотами згоряння речовин, що беруть у них участь.
Тепловий ефект реакції дорівнює різниці суми теплот згоряння початкових речовин і суми теплот згоряння продуктів реакції
Для умовної реакції виду aA+bB=cC+dD тепловий ефект може бути розрахований за такою формулою:
ΔH°=(aΔH°згор.A+bΔH°згор.B)-(cΔH°згор.C+dΔH°згор.D)
Теплоти згоряння негорючих речовин дорівнюють нулю.

