Структурна формула для води
Розглянемо порядок побудови структурної формули на прикладі молекули води.
Будуємо каркас з’єднання
Атоми з’єднання розташовані навколо центрального атома. В якості центральних атомів зазвичай виступають атоми: вуглецю, кремнію, азоту, фосфору, кисню, сірки.

Знаходимо суму валентних електронів усіх атомів сполуки
Для води: H2O = (2 · 1 + 6) = 8
В атомі водню один валентний електрон, в атомі кисню – 6. Оскільки в поєднанні присутні два атоми водню, то загальна кількість валентних електронів молекули води дорівнюватиме 8.
Визначаємо кількість ковалентних зв’язків у молекулі води
Визначаємо за формулою: S = N – A, де
- S – кількість електронів, які спільно використовуються в молекулі;
- N – сума валентних електронів, що відповідають завершеному зовнішньому енергетичному рівню атомів у поєднанні:
- N = 2 – для атома водню;
- N = 8 – для атомів інших елементів
- A – сума валентних електронів усіх атомів у з’єднанні.
Для H2О
- N = 2 · 2 + 8 = 12
- A = 2 · 1 +6 = 8
- S = 12 – 8 = 4
У молекулі води спільно використовуваних електронів – 4. Оскільки ковалентний зв’язок складається з пари електронів, то отримуємо два ковалентні зв’язки.
Розподіляємо спільні електрони
Між центральним атомом і атомами, що оточують його, має бути хоча б один зв’язок. Для молекули води таких зв’язків буде по два для кожного атома водню:
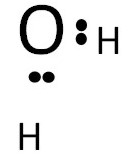
Розподіляємо електрони, що залишилися
З восьми валентних електронів чотири вже розподілено. Куди “подівати” чотири електрони, що залишилися?
Кожен атом у поєднанні повинен мати повний октет електронів. Для водню – це два електрони; для кисню – 8.
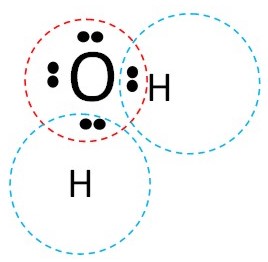
Електрони, що спільно використовуються, називаються зв’язуючими.
Формула Льюїса для молекули води:
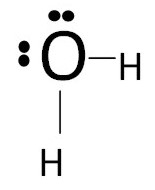
Електронно-крапкова формула та формула Льюїса наочно описують будову ковалентного зв’язку, але громіздкі та займають багато місця. Цих недоліків можна уникнути застосовуючи стислу структурну формулу, у якій вказується лише порядок “слідування” зв’язків.
Приклад стиснутої структурної формули:
- диметиловий ефір – CH3OCH3
- етиловий спирт – C2H5OH

