Основний та збуджений стан атома
Чому одні атоми можуть мати лише одну валентність, а інші – кілька? Для відповіді на це запитання звернемося до квантово-механічної моделі будови атома, згідно з якою електрони навколо атомного ядра розташовуються на так званих енергетичних рівнях.
Як відомо, атоми можуть вступати у хімічні реакції з іншими атомами, з утворенням хімічних зв’язків шляхом віддачі/прийняття своїх/чужих електронів, які називаються валентними (див. Валентність).
У періодичній таблиці хімічних елементів Д. І. Менделєєва всі атоми відображені в їхньому основному стані (стан з мінімальною енергією). Основний стан атома описується електронною конфігурацією атома, згідно з його положенням у Періодичній таблиці.
У певних ситуаціях деякі атоми, отримуючи енергію ззовні, переходять у так званий збуджений стан, в якому перебувають відносно короткий час, оскільки збуджений стан є нестабільним, після чого збуджений атом віддає енергію і повертається у свій основний (стабільний) стан.
Основний та збуджений стан атома (приклади)
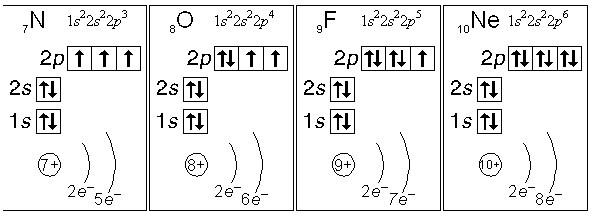
- атом азоту (N): кількість неспарених електронів: 3
- атом кисню (О): кількість неспарених електронів: 2
- атом фтору (F): кількість неспарених електронів: 1
- атом неону (Ne): кількість неспарених електронів: 0
Азот, кисень, фтор і неон не можуть мати збудженого стану з тієї простої причини, що вони не мають вільної орбіталі з більш високою енергією, на яку могли б перескакувати спарені електрони з орбіталей з меншою енергією.
Розглянемо атом сірки, який знаходиться в одній з киснем групі – 16 (VIa), але, на відміну від кисню, атом сірки має вільну d-орбіталь, що істотно розширює валентні можливості елемента:
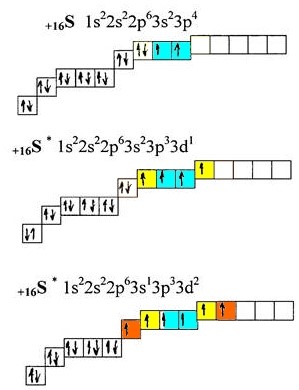
В основному стані атом сірки має 2 валентні електрони (блакитний колір). Як видно з вищенаведеного малюнка, отримуючи енергію ззовні, у атома сірки можуть з’являтися ще 2 (жовтий колір) або 4 (жовтий+помаранчевий) додаткових валентних електрона, при цьому загальна кількість валентних електронів збільшується до 4 або 6 відповідно.

