Дисоціація основ
При дисоціації основ роль аніонів грають гідроксид-іони (ОH–), інших аніонів при дисоціації основ не утворюється:
![]()
Кислотність основи визначається кількістю гідроксид-іонів, що утворюються при дисоціації однієї молекули основи:
- однокислотні основи – KOH, NaOH;
- двокислотні основи – Ca(OH)2;
- трикислотні основи – Al(OH)3.
Багатокислотні основи дисоціюють, за аналогією з кислотами, також ступінчасто – на кожному етапі відщеплюється по одному гідроксид-іону:
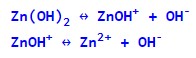
Деякі речовини, залежно від умов, можуть виступати як у ролі кислот (дисоціювати з відщепленням катіонів водню), так і в ролі основ (дисоціювати з відщепленням гідроксид-іонів). Такі речовини називаються амфотерними (див. Кислотно-основні реакції).
Дисоціація Zn(OH)2, як основи:
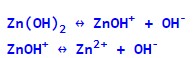
Дисоціація Zn(OH)2, як кислоти:
![]()

