Як складати рівняння іонних реакцій
Знання, котрі необхідні для складання рівнянь іонних реакцій:
- вміння відрізняти електроліт від неелектроліту;
- вміння складати рівняння дисоціації електролітів;
- вміння встановлювати значення зарядів іонів.
Довідкова інформація
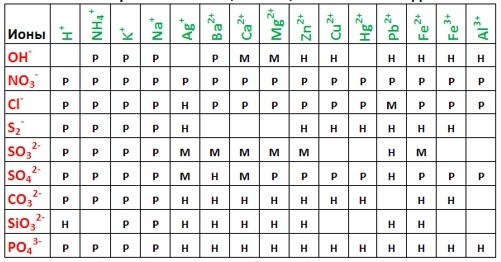
- Р – розчинні (в 1 літрі води розчиняється понад 10 г речовини)
- М – малорозчинні (0,01-10 г в 1 літрі води)
- Н – нерозчинні (менше 0,01 г в 1 літрі води)

Два види іонних рівнянь
У іонних рівняннях хімічні формули речовин записують у двох видах – як у вигляді іонів, так і у вигляді молекул. Виникає природне питання, – коли ту чи іншу речовину треба записувати у вигляді іона чи молекули?
У вигляді іонів записують формули наступних речовин:
- сильні кислоти: H2SO4, HNO3, HI…;
- сильні основи: KOH, NaOH, Ba(OH)2…;
- розчинні у воді солі: KNO3, BaCl2, NaBr…
У вигляді молекул записують формули наступних речовин:
- вода;
- слабкі кислоти: HCN, H2SO3, H3PO4…;
- слабкі основи: NH4OH, Cu(OH)2, Fe(OH)3…;
- малорозчинні солі: AgCl, CaCO3, FeS…;
- амфотерні гідроксид: Al(OH)3, Cr(OH)3, Zn(OH)2…;
- газоподібні речовини: CO2, H2, NH3,…;
- оксиди металів та неметалів: CaO, Na2O, P2O5,…
Якщо серед продуктів реакції є нерозчинні або малорозчинні речовини (осад), біля таких речовин ставлять стрілку вниз (↓). Газоподібні та леткі сполуки відповідно позначаються стрілкою, спрямованою вгору (↑).

