Що таке адіабатичний процес
Термодинамічні процеси у фізиці характеризуються чотирма параметрами:
- об’ємом;
- тиском;
- температурою;
- енергією.
Далі будуть розглядатися квазістатичні процеси, в яких зміни відбуваються досить повільно, дозволяючи тиску і температурі залишатися постійними в будь-якій точці системи.
Адіабатичний процес – це квазістатичний процес, у якому загальна теплова енергія системи залишається постійною.
Обчислюючи роботу при адіабатичному процесі, можна сказати, що теплова енергія системи дорівнює 0 (Q = 0) або U = -W.
- ΔU – зміна внутрішньої енергії системи;
- Q – теплова енергія;
- W – робота.
Оскільки внутрішня енергія ідеального газу U = (3/2)nRT, маємо наступне:
![]()
- T0, T1 – початкова та кінцева температура газу;
- n – кількість молей;
- R – універсальна постійна газова.
Графік залежності тиску від об’єму газу при адіабатичному процесі представлений нижче:
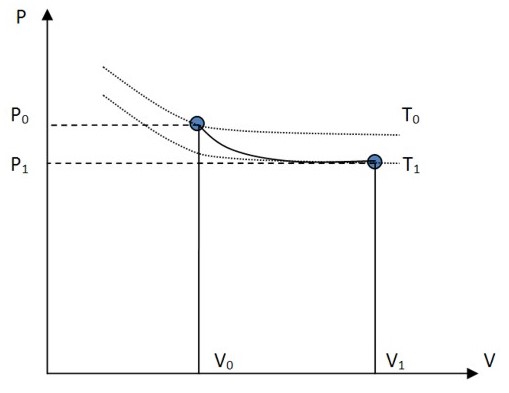
При адіабатичному процесі газ виконує роботу над оточуючими тілами при зниженні температури. На графіку область під адіабатою – це робота система, коли її загальна теплова енергія постійна.

