Оксиди (класифікація, властивості, отримання)
Оксиди – це складні хімічні речовини (складаються з атомів кількох хімічних елементів), до складу яких входить два елементи, одним із яких є кисень.
Класифікація оксидів
Оксиди, що утворюють солі:
- оснОвні (наголос на другому складі);
- кислотні;
- амфотерні.
Несолетворні оксиди:
- оксид вуглецю СО (II);
- оксид азоту NO(II).
Основні оксиди
Основними оксидами називаються оксиди, яким відповідають основи: Na2O(оксид) → NaOH(основа).
До основних оксидів відносяться оксиди лужних металів (Na2O), лужноземельних (CaO) металів, а також оксиди перехідних елементів у нижчих ступенях окиснення (MnO).
Основні оксиди мають хімічні зв’язки, близькі до іонних зв’язків.
Хімічні властивості основних оксидів:
- легко вступають у реакцію з водою: Na2O + H2O = 2NaOH
- реагують з кислотами з утворенням солі та води: MgO + H2SO4 = MgSO4 + H2O
- основні оксиди реагують із кислотними оксидами з утворенням солей: CaO + CO2 = CaCO3
- основні оксиди при нагріванні у присутності відновників відновлюються до металу, що входить до складу оксиду: CuO + H2 = Cu + H2O
Кислотні оксиди
Кислотним оксидам відповідають кислоти: SO3 → H2SO4
Кислотні оксиди мають полярні ковалентні зв’язки.
Кислотні оксиди утворюють неметали і багато перехідних металів у вищих ступенях окиснення (CrO3, CrO).
Хімічні властивості кислотних оксидів:
- взаємодіють з водою, утворюючи кислоти: SO3 + H2O = H2SO4
- деякі кислотні оксиди не взаємодіють із водою: SiO2
- реагують з основами з утворенням води та солі: SO2 + 2NaOH = Na2SO3 + H2O
- реагують з основними оксидами: P2O5 + 3K2O = 2K3PO4
Амфотерні оксиди
Амфотерні оксиди – це оксиди, які можуть виявляти (залежно від умов реакції) як основні, так і кислотні властивості: Al2O3, Cr2O3, ZnO.
Хімічні властивості амфотерних оксидів:
- не взаємодіють із водою;
- реагують з основами та кислотами:
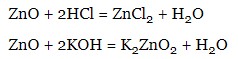
- реагують з основними та кислотними оксидами:
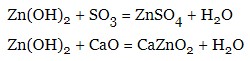
Отримання оксидів
- внаслідок горіння простих речовин: C + O2 = CO2
- внаслідок горіння складних речовин: CH4 + 2O2 = CO2 + 2H2O
- внаслідок розкладання складних речовин:
- нерозчинних основ: Cu(OH)2 = CuO + H2O
- кислот: H2SiO3 = SiO2 + H2O
- основ: CaCO3 = CO2 + H2O
- окисленням металів оксидами інших елементів: 2Al + Cr2O3 = Al2O3 + 2Cr

