Що таке електролітична дисоціація
Електролітична дисоціація (іонізація) – це процес розпаду електролітів на іони у водному розчині (розплаві)
Іони – це атоми (групи атомів), які мають заряд (позитивний – аніони або негативний – катіони).
Іони бувають:
- прості –
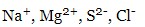
- складні –
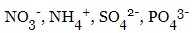
Відмінності електролітів та неелектролітів
Давно відомо, деякі розчини проводять електричний струм (такі розчини отримали назву електролітів), а деякі – не проводять (неелектроліти).
Крім електропровідності електроліти та неелектроліти мають багато інших відмінностей. При однаковій молярній концентрації електроліти (порівняно з неелектролітами) мають:
- вищу температуру кипіння;
- нижчу температуру замерзання;
- більш високий осмотичний тиск;
- нижчий тиск пари розчинника.
Таку велику різницю у властивостях розчинів вчені пояснюють тим фактом, що в електролітах при розчиненні утворюється набагато більша кількість частинок, які ще й мають заряд, хоча, загалом, розчин електроліту нейтральний.
Електролітична дисоціація
Вперше теорію електролітичної дисоціації (поділу) сформулював у 1887 р. шведський вчений С. Арреніус, її основні положення полягали у наступному:
- електроліти, розчиняючись у воді, дисоціюють (розпадаються) на позитивно (катіони) та негативно (аніони) заряджені іони;
- під впливом зовнішнього електричного поля катіони в розчині електроліту почнуть рухатися до катода (негативний електрод), аніони – до анода (позитивного електрода)
Електролітична дисоціація є оборотним процесом – паралельно з розпадом молекул на іони йде зворотний процес асоціації (іони з’єднуються в молекули), у результаті в розчині встановлюється динамічна рівновага.
Через кілька років, в 1891 р., російський учений І. Каблуков вніс суттєві уточнення в теорію Арреніуса, ввівши поняття сольватації катіонів і аніонів (формування хімічних зв’язків між розчинником і речовиною, що розчиняється).
Розчини електролітів нейтральні, тому що загальна сума зарядів аніонів завжди дорівнює загальній сумі зарядів катіонів

