Головний закон хімічної реакції
Хімія є дивовижною наукою. Наприклад, під час хімічної реакції можна отримати безпечну речовину, поєднавши дві небезпечні. Розглянемо звичайну кухонну сіль, хлорид натрію (NaCl) з точки зору електронних конфігурацій атомів натрію и хлору.
- Натрій – Na, лужний метал (група ІА).
- Електронна конфігурація: 1s22s22p63s1
- Хлор – Cl, галоген (група VIIA).
- Електронна конфігурація: 1s22s22p63s23p5
Як бачимо, натрій має один валентний електрон, який він “згоден” віддати, щоб його енергетичні рівні стали завершеними. Хлор має 7 валентних електронів і йому не вистачає одного електрона, щоб його енергетичні рівні стали завершеними. Тому хлор та натрій є дуже міцним «тандемом».
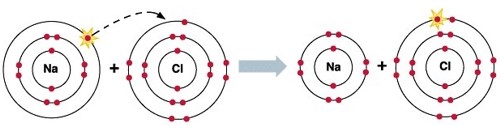
Повністю “укомплектовані” енергетичні рівні мають інертні гази (група VIIIA), у котрих заповнені зовнішні s-орбіталі і p-орбіталі. Тому вони так погано вступають у хімічні реакції з іншими елементами (їм просто не треба ні з ким “товаришувати”, оскільки ні віддавати, ні приймати електрони їм “не потрібно”).
Головний закон хімічної реакції:
хімічні елементи намагаються заповнити свій валентний енергетичний рівень.
Коли валентний енергетичний рівень заповнений – елемент стає стабільним або насиченим.
Оскільки в інертних газах зовнішні енергетичні орбіталі повністю укомплектовані, ці елементи є стабільними і дуже «неохоче» вступають в хімічні реакції з іншими елементами. Решта атомів, у яких не укомплектовані зовнішні енергетичні орбіталі, намагаються «знайти» собі «пару», як це роблять натрій і хлор. Хімічні елементи, намагаючись заповнити свій зовнішній енергетичний рівень, вступають з іншими елементами в реакції, створюючи стійкі сполуки. Оскільки заповнюються зовнішні s-орбіталі (2 електрони) і р-орбіталі (6 електронів), то цей процес отримав назву “правило октету” (октет = 8)
Запам’ятайте!
Будь-який атом може отримати або віддати не більше трьох електронів

