Електролітична дисоціація (приклади розв’язання задач)
Теоретичний матеріал дивись на сторінці “Шпаргалка по електролітичній дисоціації“.
Задача №1
Написати молекулярне рівняння, яке відповідає іонному рівнянню взаємодії іону водню (H+) з гідроксид-іоном (OH–).
- Іон водню реагує з гідроксид-іоном з утворенням молекули води (реакція нейтралізації):

- іони водню утворюються при дисоціації сильних кислот (HCl);
- гідроксид-іони утворюються при дисоціації сильних основ (NaOH).
![]()
Задача №2
Написати молекулярне рівняння, яке відповідає іонному рівнянню взаємодії іона водню з карбонат-іоном.
- карбонат-іони реагують з іонами водню з утворенням гідрокарбонат-іонів (реакція протікає при нестачі іонів водню):

- другий варіант цієї реакції – утворення нестійкої вугільної кислоти, що розпадається на воду і оксид вуглецю (протікає при надлишку іонів водню):

- Молекулярні рівняння реакцій:

Задача №3
Написати молекулярне рівняння, яке відповідає іонному рівнянню взаємодії іона срібла з гідроксид-іоном.
- іон срібла реагує з гідроксид-іоном з утворенням нестійкого з’єднання гідроксиду срібла, що розпадається на воду та оксид срібла:

- іони срібла утворюються при дисоціації розчинних солей срібла (AgNO3);
- гідроксид-іони утворюються при дисоціації сильних основ (NaOH).
![]()
Задача №4
При взаємодії яких розчинів вийде карбонат кальцію (CaCO3)?
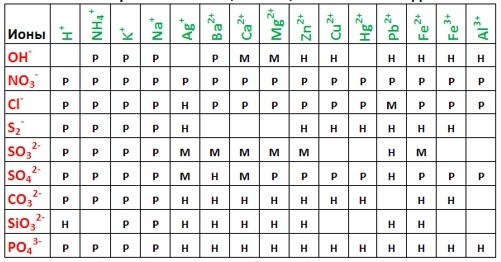
З таблиці розчинності видно, що карбонат кальцію нерозчинний у воді.
Скорочене іонне рівняння для отримання CaCO3 матиме такий вигляд:
![]()
Для вирішення задачі підійде будь-яка розчинна сполука кальцію, яка дисоціюватиме з утворенням іонів Ca2+, наприклад, хлорид кальцію (CaCl2) або нітрат кальцію Ca(NO3)2.
У якості донора іонів CO32- може виступати будь-який розчинний у воді карбонат, наприклад, Na2CO3 або K2CO3.
Один із варіантів молекулярного рівняння:
![]()
Задача №5
Розчини яких солей потрібні для отримання:
- карбонату барію BaCO3;
- фосфату кальцію (V) Ca3(PO4)2;
- сульфату свинцю PbSO4
Рішення:
- Для отримання карбонату барію BaCO3

- Для отримання фосфату кальцію Ca3(PO4)2

- Для отримання сульфату свинцю PbSO4

Задача №6
Які речовини утворюються при взаємодії розчинів сульфату натрію (Na2SO4) та хлориду барію (BaCl2)?
З таблиці розчинності видно, що обидві солі розчиняються у воді:

При поєднанні розчинів утворюються катіони натрію та барію та аніони хлору та оксиду сірки. З таблиці розчинності видно, що нерозчинну у воді сіль дасть поєднання Ba2+ та SO42-:
![]()
Рівняння реакції матиме вигляд:
![]()
Задача №7
Яка сіль випаде в осад при взаємодії нітрату срібла (AgNO3) та хлориду кальцію (CaCl2)? Написати рівняння реакції.

Ag++Cl– = AgCl↓ – хлорид срібла
Задача №8
Як можна очистити кухонну сіль (NaCl) від сульфату натрію (Na2SO4)?
Треба додати в розчин кухонної солі та сульфату натрію речовину, котра може розпадатися на іони, які зв’яжуть іони оксиду сірки в нерозчинну сіль, вивільнивши тим самим іони натрію.
Роль зв’язувальної речовини виконає хлорид кальцію CaCl2.

Після того, як CaSO4↓ випаде в осад, отриманий розчин необхідно буде відфільтрувати, після чого у фільтраті буде присутня чиста кухонна сіль.
Задача №9
Написати молекулярне та іонне рівняння реакції хлориду алюмінію з нітратом срібла.
Молекулярне рівняння:
![]()
Повне іонне рівняння:
![]()
Скорочене іонне рівняння:
![]()
Задача №10
Розрахувати концентрацію іонів, що утворюються при змішуванні 1 літра 0,25 М розчину BaCl2 і 1 літра 0,5 М розчину Na2SO4 після випадання BaSO4 в осад.
Молекулярне рівняння реакції:
![]()
Скорочене іонне рівняння:
![]()
Розрахуємо попередню кількість іонів:

(Ba2+) в обмінній реакції присутній в нестачі, тому в реакцію вступає не 0,5, а тільки 0,25 SO42-;
Об’єм отриманого розчину 1+1=2 літри;
Розрахуємо молярні концентрації іонів:

Задача №11
Розрахувати pH водяного розчину 0,1М HCl; 0,1M NaOH.
HCl – сильна кислота, що дисоціює повністю, рівняння дисоціації:

NaOH – сильна основа, що дисоціює повністю, рівняння дисоціації:

Задача №12
Розрахувати концентрацію іонів водню у розчині аміаку з концентрацією 1,5 моль/л (K=1,7·10-5).
Формула рівноваги, яка буде встановлена у водному розчині аміаку:

Позначимо через x рівноважну концентрацію [OH–]; тоді [NH4+]=x; [NH3]=1,5-x:

Задача №13
Яка кількість осаду утворюється при змішуванні 250 мл розчинів нітриту літію (концентрація 0,3 моль/л) і фториду натрію (0,2 моль/л), якщо добуток розчинності фториду літію ДР (LiF)=1,5 ·10-3.
Рівняння реакції:
![]()
Розрахуємо попередню кількість іонів:
![]()
Об’єм розчину дорівнює 0,25+0,25=0,5 л
Якщо позначити через x моль кількість осаду LiF, тоді добуток концентрації іонів у розчині дорівнюватиме:
ДР=[Li+][F–]
ДР=[(0,05-x)/0,5][(0,075-x)/0,5]=1,5·10-3
x=0,039
Маса осаду, що випав:
![]()

