Що таке електроліз
Якщо в електроліт опустити два електроди, і приєднати їх до джерела живлення, то негативно заряджені іони (аніони), що знаходяться в електроліті, почнуть притягуватися до позитивного електрода (анода), а позитивно заряджені іони (катіони) – до негативного електрода (катода) – у ланцюзі виникне постійний струм.
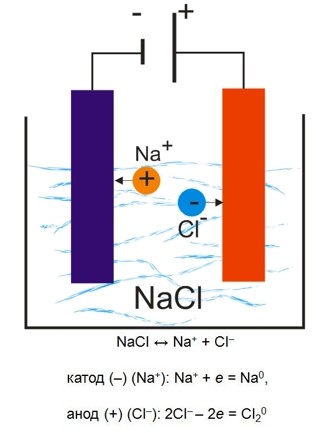
Катіони, досягнувши поверхні катода, будуть приєднувати електрони металу (відновлюватися); аніони на аноді будуть віддавати свої електрони (окислятися).
На малюнку вище показаний найпростіший випадок електролізу – у розплаві хлорид натрію дисоціює на катіони натрію та аніони хлору. Під дією електричного струму Na+ відновлюються на катоді, Cl– окислюються на аноді.
Рівняння електролізу матиме вигляд:
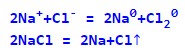
В результаті електролізу на аноді виділятиметься газоподібний хлор, а на катоді – металевий натрій.
Електроліз – це окисно-відновна реакція, що протікає на електродах при проходженні електричного струму через електроліт
Окисно-відновна реакція, що протікає при електролізі, протікає за рахунок електричної енергії – без зовнішнього джерела енергії вона неможлива.
Слід звернути увагу, що електроліз у розчині електроліту та електроліз у розплаві електроліту – трохи різні речі.
Нюанс полягає в тому, що у водному розчині електроліту крім іонів металу та кислотного залишку присутні ще й продукти дисоціації води, що необхідно враховувати.

