Приклади розв’язання задач з електролізу

Задача №1
Написати рівняння електролізу розчину хлориду калію для нерозчинного аноду.
Рішення:
![]()
електрліз на аноді (+):
![]()
електроліз на катоді (-):
![]()
Сумарне іонне рівняння:
![]()
Молекулярне рівняння:
![]()
Задача №2
Написати рівняння електролізу розчину хлориду калію для мідного (розчинного) анода.
Рішення:
![]()
анод(+):
![]()
іони міді в процесі електролізу переходять з анода на катод (виділення чистої міді на катоді):
![]()
Концентрація хлориду калію в розчині залишається постійною, тому сумарне рівняння електролізу для розчинного анода написати не можна.
Задача №3
Написати рівняння електролізу розчину гідроксиду натрію.
Рішення:
![]()
електроліз на аноді(+):
![]()
електроліз на катоді(-):
![]()
Сумарні рівняння:
![]()
Задача №4
Написати рівняння електролізу розчину хлориду цинку з вугільними електродами.
Рішення:
![]()
електроліз на аноді(+):
![]()
катод(-):
![]()
Сумарне рівняння електролізу написати не можна, оскільки невідомо скільки електрики витрачається на відновлення води, а скільки – на відновлення іонів цинку.
Задача №5
Написати рівняння електролізу водного розчину нітратів міді (II) та срібла з нерозчинними електродами.
Рішення:
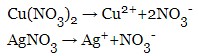
електроліз на аноді(+):
![]()
електролізи на катоді(-):
![]()
Згідно з положенням металів у ряді напруг (див. вище), катіони срібла будуть відновлюватися першими, катіони міді – в останню чергу.
Іонні рівняння:
![]()
Молекулярні рівняння: