Правила електролізу водних розчинів
Електроліз на катоді
Електроліз на катоді залежить від положення металу в електрохімічному ряду напруг:
- якщо катіон електроліту стоїть ліворуч від алюмінію (включно), на катоді відновлюється вода з виділенням водню, а катіони металу залишаються в розчині:
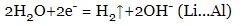
- якщо катіон електроліту стоїть між алюмінієм та воднем, на катоді відновлюються і вода, і катіони металу:
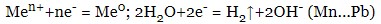
- якщо катіон електроліту стоїть правіше водню, на катоді відновлюється тільки катіони металу:
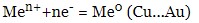
- якщо в розчині електроліту знаходиться кілька металів, першими відновлюються катіони металу, які у ряді напруг стоять правіше за інші.
Електроліз на аноді
Електроліз на аноді залежить тільки від матеріалу, з якого виготовлений анод:
- у разі розчинного анода (метали, що окислюються в процесі електролізу – залізо, мідь, цинк, срібло) – завжди йде процес окислення металу аноду:
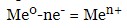
- у разі нерозчинного анода (золото, платина, графіт):
- йде процес окислення аніону при електролізі розчинів солей безкисневих кислот, за винятком фторидів:
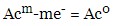
- йде процес окислення води в інших випадках (електроліз оксикислот та фторидів) – аніон залишається в розчині:
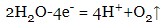
- при електролізі розчинів лугів окислюються гідроксид-іони:
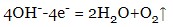
- йде процес окислення аніону при електролізі розчинів солей безкисневих кислот, за винятком фторидів:
- відновлювальна активність аніонів зменшується в ряду (відповідно збільшується здатність окислюватися):

Промислове застосування електролізу
- Виділення та очищення металів.
- Одержання алюмінію, магнію, натрію, кадмію.
- Одержання лугів, хлору, водню.
- Очищення міді, нікелю, свинцю.
- Процеси напилення захисних покриттів із метою захисту металів від корозії.


