Основи: сильні та слабі основи, хімічні властивості
Основи – це речовини, які дисоціюють у водних розчинах з утворенням катіон-металів та гідроксид-іонів (див. Електролітична дисоціація та Дисоціація основ):
![]()
Основи, що розчиняються у воді, називаються лугами.
Приклади сильних основ:
- NaOH – гідроксид натрію (їдкий натр);
- KOH – гідроксид калію (їдке калі);
- LiOH – гідроксид літію;
- Ba(OH)2 – гідроксид барію;
- Ca(OH)2 – гідроксид кальцію.
Приклади слабких основ:
- Mg(OH)2 – гідроксид магнію;
- Zn(OH)2 – гідроксид цинку;
- Fe(OH)2 – гідроксид заліза(II);
- Fe(OH)3 – гідроксид заліза(III);
- NH4OH – гідроксид амонію.
Основи змінюють забарвлення індикаторів:
- метиловий оранжевий – жовтий колір;
- фенолфталеїн – малиновий колір;
- лакмус – синій колір.
Хімічні властивості основ
- реагують із кислотами (реакція нейтралізації): NaOH + HCl = NaCl + H2O
- реагують із кислотними оксидами: 2NaOH + SiO2 = Na2SiO3 + H2O
- реагують із солями: 3NaOH + FeCl3 = 3NaCl + Fe(OH)3↓
- розкладаються (нерозчинні у воді) при нагріванні на воду та оксид: 2Fe(OH)3 = Fe2O3 + 3H2O
Способи отримання основ
- взаємодією металів з водою (тільки луги): 2Na + 2H2O = 2NaOH + H2↑
- взаємодією оксидів металів з водою (тільки луги): K2O + H2O = 2KOH
- дією лугу на водні розчини солей (нерозчинні основи): FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
- електролізом розчинів солей (промисловий спосіб отримання їдкого калі та їдкого натру):
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑
Амфотерні гідроксиди
Амфотерні гідроксиди одночасно виявляють як основні (дисоціюють з утворенням гідроксид-іонів), так і кислотні (при дисоціації утворюють катіони водню) властивості.
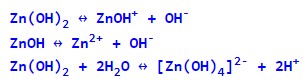
Приклади амфотерних гідроксидів:
- Pb(OH)2 – гідроксид свинцю(II);
- Zn(OH)2 – гідроксид цинку;
- Fe(OH)3 – гідроксид заліза(III);
- Al(OH)3 – гідроксид алюмінію(III);
- Be(OH)2 – гідроксид берилію.
Амфотерні гідроксиди реагують як з кислотами, так і з основами, утворюючи воду і сіль:
![]()

