Кислоти (класифікація, властивості, отримання)
Кислоти дисоціюють у воді тільки на катіони водню та аніони кислотного залишку (див. Дисоціація кислот):
![]()
Всі кислоти можна розділити на дві великі групи:
- кисневі: H2SO4, HNO2
- безкисневі: HCl, H2S
По основності кислоти діляться на 3 групи (основність кислоти визначається кількістю атомів водню, які можуть заміщатися на атоми металу):
- одноосновні кислоти: HCl, HF, HNO3;
- двоосновні кислоти: H2SO4, H2CO3;
- триосновні кислоти: H3PO4.
Сила кисневої кислоти тим більша, чим більша різниця між числом атомів кисню та водню в її молекулі:
- сильні кислоти: HClO4; H2SO4
- слабкі кислоти: HClO; H2SO3
Кислоти змінюють забарвлення індикаторів:
- фенолфталеїн – втрачає колір;
- лакмус – червоний колір.
Хімічні властивості кислот
Кислоти взаємодіють з металами, які стоять в електрохімічному ряді напруги до водню (Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Ph), при цьому як окислювач металу виступає катіон водню:
Zn + 2HCl = ZnCl2 + H2
- при взаємодії металів з концентрованою сірчаною або азотною кислотою катіон водню не виділяється, роль окислювача в цьому випадку на себе беруть атоми сірки (ступінь окислення +6) або азоту (+5) відповідно, що знаходяться у вищих ступенях окислення:
5H2SO4 + 4Zn = 4ZnSO4 + H2S + 4H2O - кислоти взаємодіють з основними оксидами з утворенням солі та води:
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O - взаємодіють з основами з утворенням солі та води:
LiOH + HCl = LiCl + H2O - можуть взаємодіяти з солями, але тільки у випадках з сильнішою кислотою та сіллю, яка утворена слабшою кислотою (при цьому випадає осад або виділяється газ):
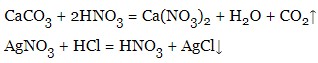
Отримання кислот
Отримання безкисневих кислот:
- взаємодія водню з неметалами:
H2 + Cl2 = 2HCl - дією концентрованої сірчаної кислоти на відповідну сіль при нагріванні:
2NaCl + H2SO4 = Na2SO4 + 2HCl↑
Отримання кисневмісних кислот:
- дією сильнішого кислотного оксиду на кислоту:
H2CO3 + SO3 = CO2 + H2SO4 - взаємодією кислотних оксидів з водою (крім SiO2):
SO3 + H2O = H2SO4

