Механізм електролітичної дисоціації
Електроліти бувають двох видів: розчини з іонним зв’язком та розчини з ковалентним зв’язком.
Розчинники, в яких відбувається процес дисоціації, обов’язково складаються з полярних молекул.
Механізм дисоціації електролітів з іонним та ковалентним зв’язком різний.
Дисоціація хлориду натрію
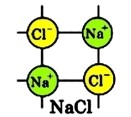
Хлорид натрію є речовиною з іонним зв’язком, у вузлах кристалічної решітки NaCl знаходяться іони натрію та хлору.
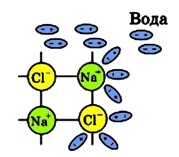
При зануренні кухонної солі у воду на першій стадії розчинення (дисоціації NaCl) полярні молекули води під дією електростатичного тяжіння приклеюються своєю негативною стороною до катіонів натрію (Na+), а позитивною стороною до аніонів хлору (Cl–):
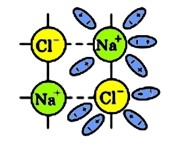
По мірі склеювання молекул води з іонами натрію та хлору відбувається ослаблення іонних зв’язків Na+ з Cl–:
Кристалічна решітка поступово руйнується, в результаті чого, іони, що звільнилися, переходять в розчин, в якому вони відразу ж зв’язуються з молекулами води – такі іони називаються гідратованими.
Іонні зв’язки хлориду натрію розриваються і гідратовані іони переходять у розчин:
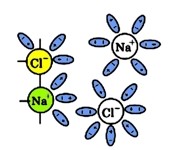
У водяному розчині дисоціація іонних сполук завжди протікає повністю.
Дисоціація хлороводню
Хлороводень є речовиною з ковалентним полярним зв’язком.
Під впливом молекул води ковалентні зв’язки поляризуються ще більше і стають іонними зв’язками, після чого відбувається процес, описаний вище:

Зі сказаного вище можна зробити висновок, що електролітична дисоціація можлива в полярних розчинниках (вода, етиловий спирт). При дисоціації в першу чергу розриваються найбільш полярні зв’язки (найбільша різниця в електронегативності атомів, що складають зв’язок; див. Поняття електронегативності).
Розчинник виконує не тільки роль поділу катіонів і аніонів речовини, що розчиняється, але також уповільнює зворотний процес асоціації іонів у вихідну молекулу, оскільки сольватовані (гідратовані) іони оточені “прилиплими” молекулами розчинника, що заважає зближенню (під впливом кулонівського електростатичного тяжіння) і з’єднанню катіонів та аніонів. Кількість молекул розчинника, що є у гідратної оболонці іонів, залежить від природи іонів, концентрації і температури розчину.
Одна з головних відмінностей дисоціації електролітів з полярним зв’язком від дисоціації електролітів з іонним зв’язком полягає в тому, що така дисоціація може бути частковою – це залежить від полярності зв’язків у молекулах електролітів.
Рівняння електролітичних дисоціацій записуються так:
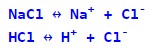
Електролітична дисоціація відбувається за рахунок енергії, що виділяється в процесі руйнування кристалічної решітки розчинної речовини під час взаємодії молекул розчинника з речовиною. Слід сказати, що дисоціація може протікати і без розчинника, наприклад, за високої температури, коли утворюється розплав речовини (енергія для руйнування кристалічної решітки береться із зовнішнього джерела високої температури).
Електролітична дисоціація – це процес розпаду речовини (електроліту) на іони (в розчинах під впливом полярних молекул розчинника; в розплавах – під впливом високої температури).

